M1 STIS
Sciences, Techniques et ingénierie de la santé
Navigation :
NF KappaB : Suppresseur de tumeur ou oncogène ?
Réponse cellulaire à l'oncogène Ras
Membrane et récepteur Fas dans l’apoptose induite par le cisplatine
Régulation du gène suppresseur de tumeur p53
- Les protéines de la famille p53
- Les protéines de la famille ASPP
- Régulation de p53 par les protéines de la famille ASPP
Nouveaux composants dans la signalisation de la maladie de Parkinson
Liens externes :
NF KappaB : Suppresseur de tumeur ou oncogène ?
II Structure, fonction et régulation de NF-kB
Le facteur de transcription NF-kB a servi comme modèle pour les facteurs de transcription inductibles depuis plus de 20 ans. Les nombreux stimuli qui activent NF-kB et le grand nombre de gènes régulés par NF-kB font que ce facteur de transcription est toujours le sujet d’intenses recherches.
La famille des facteurs de transcription NF-kB est constituée de cinq membres, p50, p52, p65 (Rel1), c-Rel et Rel B, encodés respectivement par NFKB1, NFKB2, REL A, REL et REL B, qui partagent en N-terminal le domaine d’homologie Rel (RHD). Ce domaine est responsable de la liaison à l’ADN et de l’homo et l’hétéro-dimérisation (figure 2). NF-kB se lie aux sites kB présents sur le promoteur de ces gènes cibles et régule la transcription via le recrutement de coactivateurs et de corépresseurs. Le domaine d’activation de la transcription (TAD) nécessaire pour la régulation positive de l’expression des gènes est présent uniquement sur p65, c-Rel et Rel B. Comme ils ne présentent pas de TADs, p50 et p52 peuvent réprimer la transcription à moins qu’ils ne s’associent à un membre de la famille de NF-kB contenant un domaine TAD ou à d’autres protéines capables de recruter des coactivateurs.
Il existe des informations structurales considérables sur NF-kB à la fois dans sa forme de liaison à IkB inactive et dans son état de liaison à l’ADN actif. Les structures de NF-kB se liant aux sites kB ont permis de comprendre comment les domaines Ig-like, qui comprennent le domaine RHD, contactent l’ADN. La partie N-terminale des domaines Ig-like confère la sélectivité pour certains types de sites kB, tandis que les résidus hydrophobes présents dans le domaine C-terminal fournissent l’interface de dimérisation entre les sous-unités de NF-kB. Dans son état inactif, les dimères de NF-kB sont associés avec l’une des trois protéines de IkB : IkBα (NFKBIA), IkBβ (NFKBIB) ou IkBε (NFKBIE) ou au précurseur des protéines p100 (NFKB2) et p105 (NFKB1). Ces protéines IkBs maintiennent les dimères d’NF-kB dans le cytoplasme et ont un rôle crucial dans le signal de réponse. Il y a deux inductibles exprimés, les protéines IkB, Bcl-3 (BCL3) et IkBζ (NFKBZ), dont la fonction diffère un peu dans l’inactivation (= refulation) de NF-kB. Toutes les protéines IkB sont caractérisées par la présence de multiples domaines « ankyrin » (italique ou guillemets) répétés (figure 2). Le membre de la famille le plus étudié est IkBα. Il est rapidement dégradé durant l’activation de la voie de signalisation NF-kB consuisant à la libération de multiples dimères de NF-kB. De plus, l’hétérodimère p65/p50 est une des premières cibles de IkBα. Le modèle établi consiste à ce que IkBα retienne les dimères d’NF-kB dans le cytoplasme, prévenant ainsi leur translocation nucléaire et leur liaison à l’ADN.
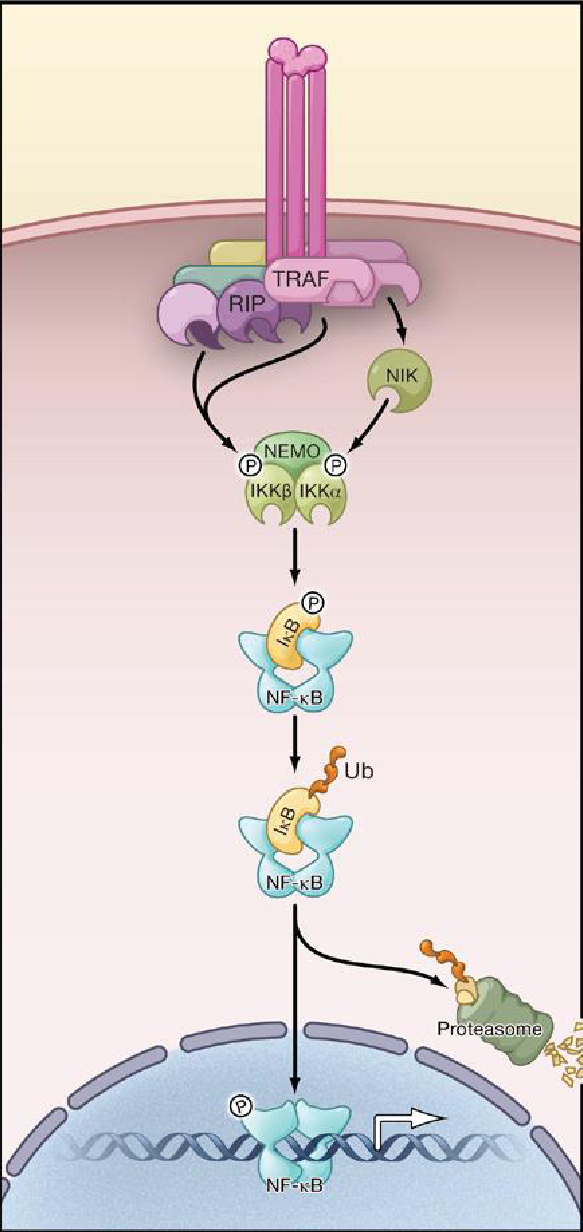
La signalisation de NF-kB consiste en une série d’éléments régulateurs positifs et négatifs. Dans sa forme la plus basique, la voie de signalisation consiste en des récepteurs et des molécules adaptatrices : le complexe IKK avec les protéines IkB et les dimères NF- kB. L’induction d’un stimuli déclenche l’activation d’IKK, entraînant ainsi la phopshorylation, l’ubiquitination et la dégradation des protéines IkB (figure 1). Les dimères de NF-kB libérés sont ensuite activés via des modifications post traductionnelles et sont transloqués dans le noyau où ils se lient à des séquences spécifiques et induisent la transcription de gènes cibles.
La dégradation d’IkB induit rapidement des événements de signalisation qui sont initiés par des phosphorylations spécifiques de ces molécules par IKK activé. Le complexe IKK contient deux sous-unités kinases fortement homologues, IKKα/IKK1 (CHUK) et IKKβ/IKK2 (IKBKB), ainsi que la sous-unité régulatrice NEMO (NF-kB essential modulator)/IKK γ (IKNKG). Ils sont généralement trouvés sous la forme d’un complexe kinase hétérodimérique.
La régulation de l’expression des gènes est un élément central de la physiologie et est la clé de l’habilité des organismes multicellulaires à s’adapter aux stress environnementaux, mécaniques, chimiques et microbiologiques. En raison de son importance dans les maladies, NF-kB a servi de modèle de réponses qui sont orchestrées via les facteurs de transcriptions inductibles aussi bien au niveau cellulaire et tissulaire qu’au niveau des organismes. NF-kB joue son plus important rôle dans les systèmes immunitaires en régulant l’expression d’inducteurs et d’effecteurs en de nombreux points qui définissent la réponse aux pathogènes. NF-kB intervient également dans la régulation de la transcription au-delà des limites de la réponse immunitaire, en influençant l’expression des gènes qui ont un impact sur la survie cellulaire, la différenciation et la prolifération.
RDH: Rel homology domain ; TAD: transactivation domain ; LZ: leucine zipper domain ; GRR: glycine- rich region ; HLH: helix-loop-helix domain ; Z: zinc finger domain ; CC1/2: coiled-coil domains ; NBD: NEMO-binding domain ; MOD/UBD: minimal oligomerization domain and ubiquity-binding domain; DD: death domain.