M1 STIS
Sciences, Techniques et ingénierie de la santé
Navigation :
NF KappaB : Suppresseur de tumeur ou oncogène ?
Réponse cellulaire à l'oncogène Ras
Membrane et récepteur Fas dans l’apoptose induite par le cisplatine
Régulation du gène suppresseur de tumeur p53
- Les protéines de la famille p53
- Les protéines de la famille ASPP
- Régulation de p53 par les protéines de la famille ASPP
Nouveaux composants dans la signalisation de la maladie de Parkinson
Liens externes :
Identification de nouveaux composants dans la voie de signalisation de la maladie de Parkinson
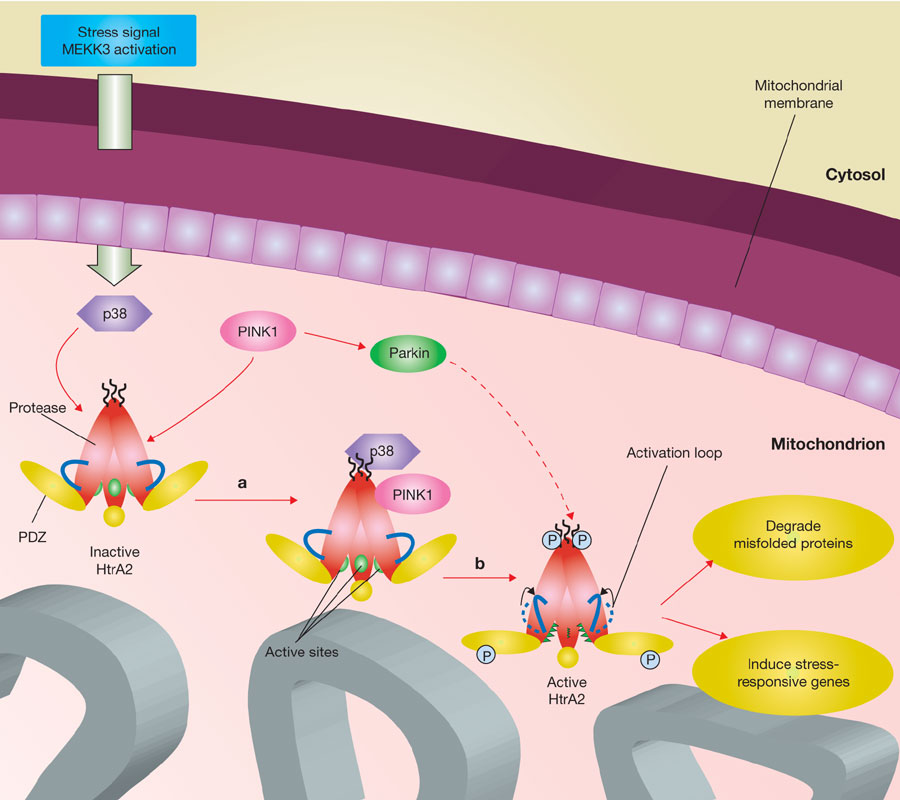
La protéine Htra2 :
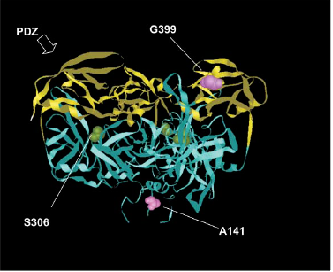
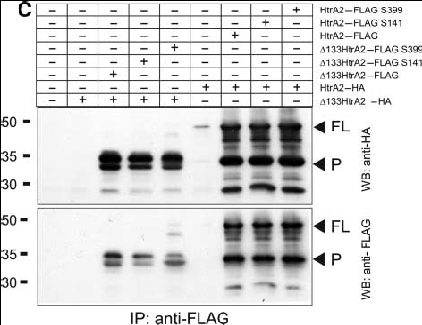
Récemment, la perte ciblée de la sérine protéase nucléaire Omi/HtrA2 est à l'origine de neurodégénérescence et de phénotype parkinsonien chez la souris. Cette protéine fait partie de la famille des PDZ domaine. Grâce à l'utilisation de l'approche gène candidat, la mutation Omi /HtrA2 de PD a été dépisté chez des patients allemands au niveau de la substance noire. Chez quatre patients, il a été identifié une nouvelle mutation hétérozygote G399S, qui était absente au niveau des contrôles sains. En outre, il a été identifié un nouveau polymorphisme A141S (Alanine substituée en sérine en position 141) qui a été associé à PD. Les deux mutations (G399S et A141S) conduisent à des substitutions d'acides aminés qui se trouvent au niveau N-terminal d'Omi/HtrA2, ainsi que dans le domaine PDZ. A141S et G399S empêchent l'activité protéolytique d’Omi/HtrA2.
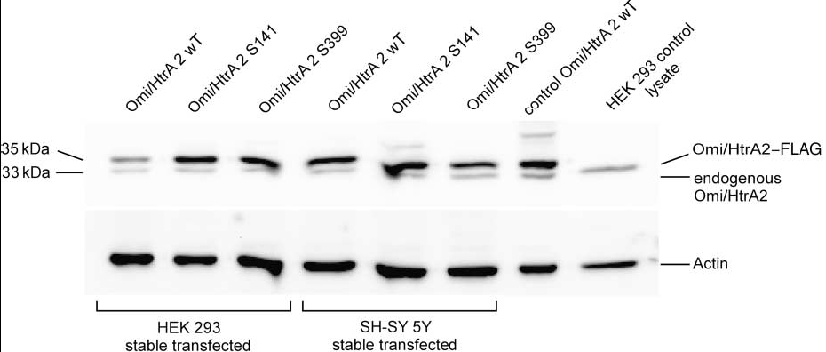
De plus l'immunohistochimie et l'analyse fonctionnelle dans des cellules transfectées de façon stable, ont révélé que S399 mutant d’Omi/HtrA2 et le risque de l'allèle du polymorphisme A141S, induisaient un dysfonctionnement mitochondrial associé à la morphologie de la mitochondrie. En comparaison avec le type sauvage (WT), Omi/HtrA2 muté possède des mitochondries plus élargies. Ensuite, les vestiges de désagrégation des mitochondries et de lysosomes dans les cellules HEK293 pourraient être un mécanisme de mort cellulaire comme l'autophagie. Une mutation de G399 entrainerait un effet toxique par rapport à A141, sur le dysfonctionnement des mitochondries en termes de mort cellulaire.
Les cellules surexprimant S399 mutant d’Omi/ HtrA2 ont été plus sensibles aux stress des cellules mortes que le WT. Par ailleurs Omi/HtrA2 est présent dans le halo du corps de Lewy. Ainsi sur la base de la génomique fonctionnelle, Omi/HtrA2 est donc associé à cette maladie neurodégénérative chez l'homme, de part un lien entre stress et dysfonctionnement mitochondrial (dans la substance noire).
La caractéristique majeure que l’on observe dans les tissus des patients atteints de Parkinson est la présence de corps de Lewy, ce sont de petites inclusions situées à l'intérieur des neurones constituées d’ α-synucléine (α–syn). Cette protéine de 140 acides aminés, est impliquée dans la maladie de Parkinson lorsqu’elle est phosphorylée sur la Ser-129, lorsque le gène est présent en triplicat ou bien possède l’une des trois mutations suivantes: A53T, A30P, ou E46K.
La surexpression de α-syn sauvage ou mutante dans le SNC reproduit la neurodégénération visible dans la maladie de Parkinson. Elle peut moduler l’expression des gènes impliqués dans la synthèse de dopamine, affecter les enzymes permettant un remodelage de la chromatine et les signaux de transduction. Des études ont montré que la phosphorylation de α-syn sur la Ser-129 est comparable à l’effet de mutations associées à la maladie de Parkinson et à un stress oxydatif.
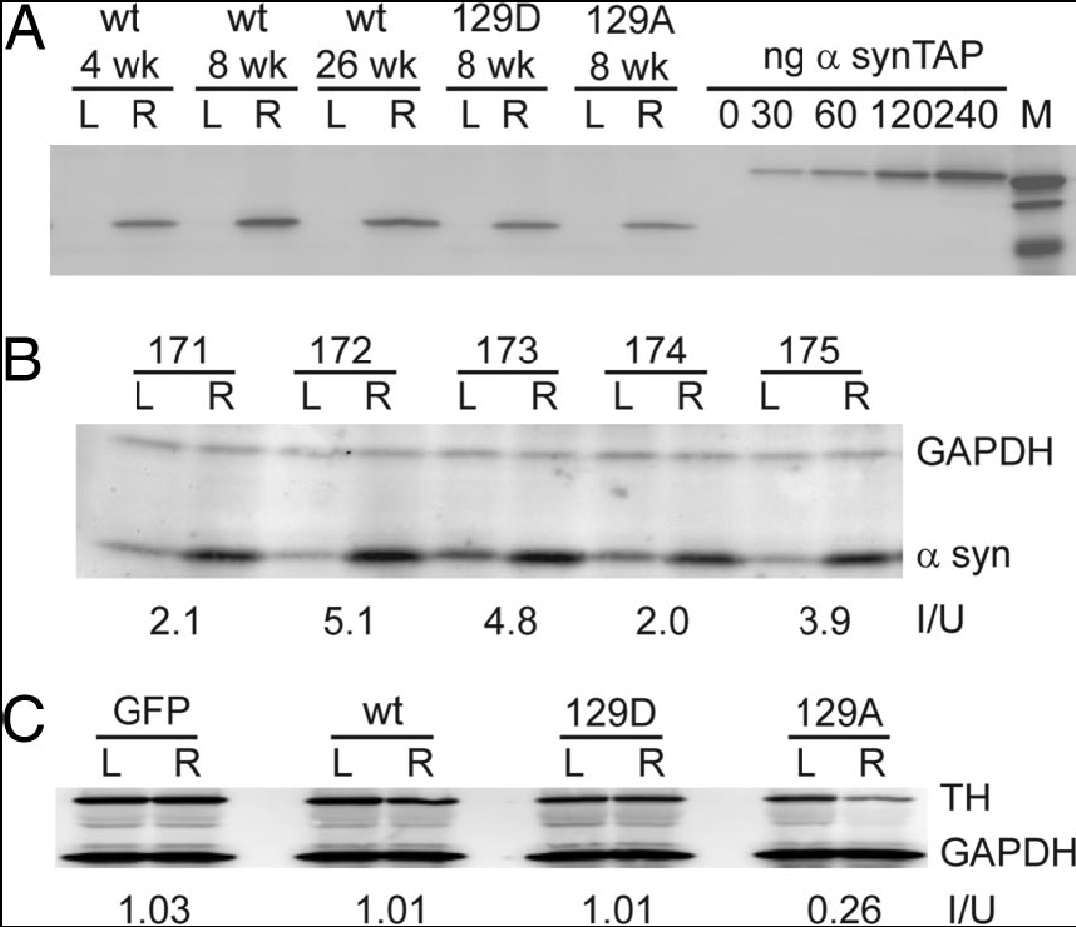
L’adénovirus recombinant exprimant la protéine α-syn sauvage (phosphorylée sur Ser-129) ou mutantes S129A (substitution de la sérine 129 par l’alanine, qui ne peut être phosphorylée) et S129D (substitution de la sérine 129 par l’aspartate, qui mime la phosphorylation), ont été injecté aux rats pour déterminer le niveau de neurodégénération. La protéine α-syn est révélée avec un anticorps spécifique anti α-syn.
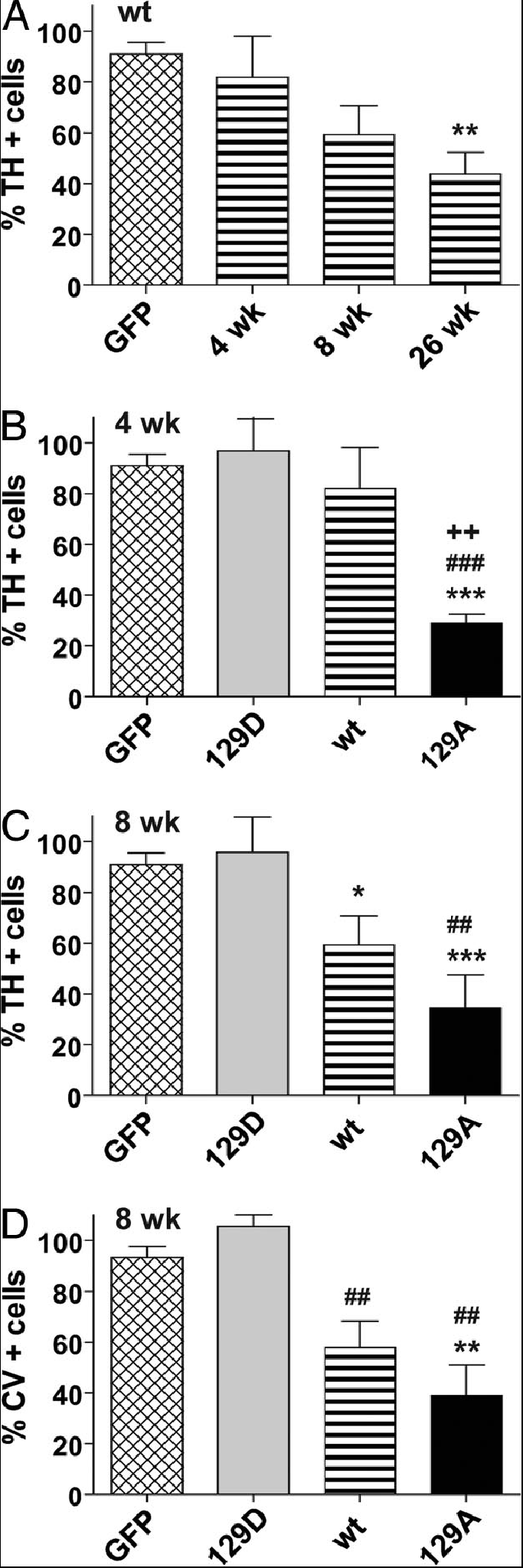
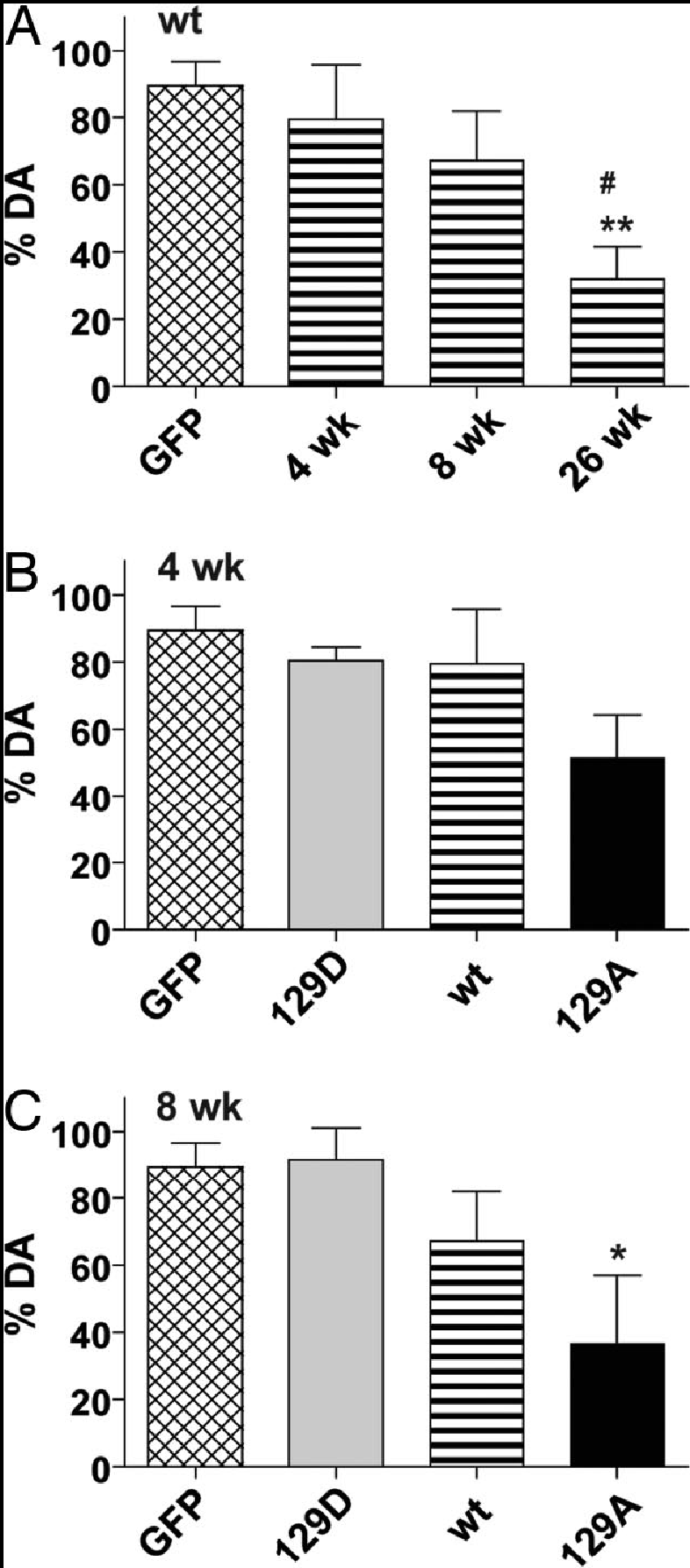
Les α-syn sauvages et mutées sont présentes sur le côté droit du striatum, le côté gauche servant de contrôle : le gène de la protéine est exprimé. Leur taux, 8 semaines après l’injection, est sensiblement le même.
La réduction du taux de dopamine est en corrélation avec le nombre de neurones TH. La surexpression de α-syn sauvage et mutante S129A produit un effet toxique caractérisé par une perte en neurones TH et en dopamine. Par contre, la surexpression de α-syn mutante S129D ne produit aucune toxicité : il n’y a pas de perte de neurones TH, ni de dopamine. L’identification de kinases et phosphatases spécifiques impliquées pourraient être les cibles de nouveaux médicaments dans le traitement de la maladie de Parkinson.