M1 STIS
Sciences, Techniques et ingénierie de la santé
Navigation :
NF KappaB : Suppresseur de tumeur ou oncogène ?
Réponse cellulaire à l'oncogène Ras
Membrane et récepteur Fas dans l’apoptose induite par le cisplatine
Régulation du gène suppresseur de tumeur p53
- Les protéines de la famille p53
- Les protéines de la famille ASPP
- Régulation de p53 par les protéines de la famille ASPP
Nouveaux composants dans la signalisation de la maladie de Parkinson
Liens externes :
Rôle des caractéristiques membranaires et du récepteur de mort Fas dans l’apoptose induite par le cisplatine
II Mécanismes de résistance
Introduction :
Le but majeur de la chimiothérapie est d’induire l’apoptose des cellules tumorales par exposition à des antitumoraux. Cependant certaines tumeurs sont capables de présenter une résistance à ces médicaments et le cisplatine est un de ces agents anticancéreux dont l’action est diminuée dans certains cas par la présence de résistances.
Celle-ci peut être acquise soit par exposition chronique soit par un mécanisme intrinsèque et parfois elle change toute l’approche thérapeutique. En effet certaines tumeurs nécessitent des doses 50 à 100 fois plus importantes que des tumeurs sensibles.
En général la résistance est un phénomène multifactoriel et dans le cas du cisplatine ces mécanismes vont être détaillés ci-dessous.
Réduction de l’accumulation intracellulaire :
Il a été montré que dans certaines lignées cellulaires la résistance était augmentée de 3 à 40 fois par rapport à des lignées normales, or cette résistance était corrélée à une diminution de 20 à 70% de la concentration en cisplatine intracellulaire (Kelland, 1993). Le phénomène peut s’expliquer de plusieurs manières.
La 1ère est qu’il y a une diminution de la fixation et de l’entrée du cisplatine dans la cellule probablement par un changement des propriétés de diffusion passive de la molécule. La 2ème explication est qu’il y a une augmentation de l’efflux du médicament depuis la cellule vers la matrice extracellulaire. Un canal Na+/K+/ATPase pourrait également avoir un rôle dans le transport du cisplatine et son inhibition serait une explication de la résistance rencontrée (Andrews et al., 1988 ; Gately et Howell, 1993).
Augmentation de l’inactivation par les thiols :
Une fois activé par hydratation, le cisplatine est capable d’interagir avec des composés nucléophiles tels que la GSH et la metallothioneine. Ces molécules contiennent des thiols qui induisent une résistance en diminuant le taux de cisplatine libre dans la cellule. L’augmentation de GSH est fréquente dans les lignées résistantes et semble corrélée à la surexpression du gène de la γ-glutamylcystéine synthétase (γ-GCS) qui est une enzyme intervenant dans la voie de synthèse de la GSH mais également à l’expression de la protéine Bcl-2 qui aurait ici un autre rôle antiapoptotique que celui de balance avec Bax (Hockenbery et al., 1993 ; Chiao et al., 1995). L’augmentation de l’activité transcriptionnelle du gène de c-Jun semble induire cette surexpression de γ-GCS (Mistry et al., 1991 ; Godwin et al., 1992 ; Hamaguchi et al., 1993 ;Pan et al., 2002). La γ-glutamyltransférase (γ-GT) voit elle aussi son expression augmentée dans les cas de résistance au cisplatine. Il s’agit d’une enzyme de synthèse de la cystéinylglycine qui est un composé interagissant 10 fois plus avec le cisplatine que la GSH.
Augmentation de la réparation de l’ADN :
La formation et la persistance des adduits de l’ADN est essentielle pour l’apoptose induite par le cisplatine. Il a été montré, dans certaines lignées résistantes, une augmentation des réparations de l’ADN. Ce phénomène n’est pas général mais est significatif. Il permet une résistance 1.5 à 2 fois supérieure.
La topoisomérase II semble elle aussi impliquée dans ce mécanisme car elle est surexprimée dans certaines lignées cellulaires résistantes (Ali-Osman et al., 1993 ; Hengstler et al., 1999). D’autres protéines impliquées dans la réparation de l’ADN sont surexprimées dans les tumeurs résistantes notamment XPA, ERCC1 et BRCA1.
Nous retrouvons ici la protéine HMG1 dans son rôle d’inhibition de la réparation de l’ADN par fixation à l’adduit. Les protéines p53 et MMR inhibent la voie de tolérance aux dommages de l’ADN et obligent ainsi la cellule à essayer de le réparer.
La Figure 3 montre bien comment la surexpression de molécules réparatrices de l’ADN permet à la cellule de survivre aux dommages du cisplatine.
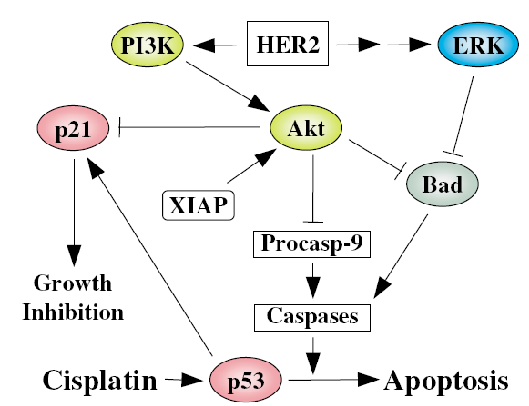
Surexpression de HER-2/neu et de la voie de la PI3-K/Akt :
HER-2/neu est un proto-oncogène qui code pour un récepteur transmembranaire à activité tyrosine kinase de 185kDa. Une petite partie des réponses des cancers humains au cisplatine est associée à la surexpression de HER-2/neu. Il va y avoir alors activation de la phosphatidyl inositol 3 kinase (PI3K) qui va activer l’expression du facteur Akt. Cette molécule agit de trois manières différentes sur les résistances au cisplatine (Figure 4) :
- inhibition de p21 et donc inhibition de la prolifération ;
- inhibition de la pro-caspase 9 et donc de la voie des caspases qui induisent l’apoptose ;
- inhibition de Bad, en synergie avec ERK (activé par HER-2), qui va inhiber à son tour les caspases.
Il existe d’autres mécanismes de résistance plus complexes impliquant la voie des MAP kinases, et plus précisément certains facteurs de cette voie, comme Ras et p53 qui peuvent être mutés.