M1 STIS
Sciences, Techniques et ingénierie de la santé
Navigation :
NF KappaB : Suppresseur de tumeur ou oncogène ?
Réponse cellulaire à l'oncogène Ras
Membrane et récepteur Fas dans l’apoptose induite par le cisplatine
Régulation du gène suppresseur de tumeur p53
- Les protéines de la famille p53
- Les protéines de la famille ASPP
- Régulation de p53 par les protéines de la famille ASPP
Nouveaux composants dans la signalisation de la maladie de Parkinson
Liens externes :
Régulation du gène suppresseur de tumeur p53
II Les protéines de la famille ASPP
Présentation et structure
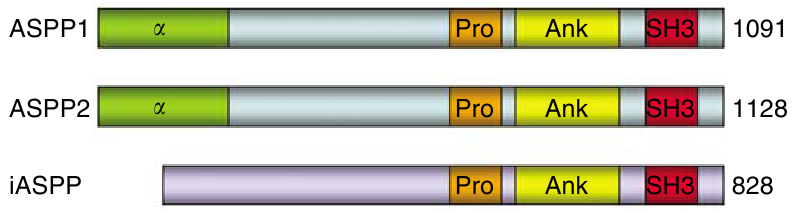
Découverte récemment, la famille de protéines ASPP (Apoptosis Stimulating Proteins of p53) est constituée de trois membres, ASPP1, ASPP2 et iASPP. En terme d’évolution, iASPP semble être la plus ancienne car c’est la seule que l’on retrouve présente chez Caenorhabditis elegans. En effet, ASPP1 et ASPP2 ne sont pas présentes chez cette espèce alors qu’elles semblent présentes chez les mammifères.
Ces protéines ont également la particularité d’intéragir avec p53 et de réguler son activité. Les protéines ASPP1 et ASPP2 semblent être des protéines permettant d’activer la voie de l’apoptose médiée par p53 et seraient donc des gènes suppresseurs de tumeurs. Inversement, iASPP semble inhiber cette même voie. Pourtant cette protéine ne semble pas inhiber l’arrêt du cycle cellulaire médié par p53. L’étude plus approfondie de ces protéines pourrait donc permettre de mieux comprendre les moyens que possède la cellule pour « choisir » entre l’apoptose et l’arrêt du cycle.
Ces trois protéines présentent des similitudes au niveau de leur partie C-terminale. Ce site semble être le site privilégié pour la fixation des partenaires de la famille protéique, parmi lesquels p53. iASPP diffère des deux autres membres de la famille par son extémité N-terminale. Il semble que la partie C-terminale soit celle impliquée dans les contacts avec les autres protéines, et notamment p53. La partie N-terminale est conservée chez les membres pro-apoptotiques alors que iASPP a une extrémité N-terminale différente. Le domaine en hélice α n’est pas présent.
Fonctions et régulation
Les protéines ASPP1 et ASPP2 seraient donc des protéines pro-apoptotiques alors que iASPP serait plutôt un proto-oncogène. Des études récentes ont par ailleurs montré que l’expression d’ASPP1 et 2 était pertubée dans de nombreux types de cancers. En effet, l’expression de ces protéines est par exemple diminuée dans certains cancers du cerveau, alors que ces tumeurs ne présentent pas de mutation de p53. D’autres types de tumeurs présentent une augmentation du taux d’ASPP1 et une diminution du taux de iASPP.
Trois mécanismes clés semblent intervenir dans la régulation du niveau d’expression des protéines ASPP. Tout d’abord, les gènes codant pour ASPP1 et ASPP2 sont soumis à une régulation par méthylation. En effet, le gène d’ASPP2 est par exemple maintenu réprimé par la protéine MBD1, qui a pour fonction de méthyler le promoteur d’ASPP2. D’autre part, l’hyperméthylation dans la région 5’UTR des gènes d’ASPP1 et 2 est corrélée avec une diminution du taux d’expression de la protéine. Ensuite, ces protéines sont sous la dépendance du facteur de transcription E2F1 dont l’activité est régulée par la protéine Rb. Enfin, ASPP2 semble être régulée par une dégradation dans le protéasome, après avoir été chargée par de l’ubiquitine.